近日,国际期刊《自然・化学》(Nature Chemistry)在线发表了武汉大学药学院、中南医院药学研究院教授陈文青课题组、副教授张郑宇课题组与厦门大学教授王斌举课题组联合完成的重要研究,论文题为“A two-metalloenzyme cascade constructs the azetidine-containing pharmacophore(两个金属酶组成的级联反应可高效合成氮杂环丁烷类药效基团)”。武汉大学博士后龚蓉、博士研究生瞿瑶与厦门大学博士后刘佳为共同第一作者,陈文青、王斌举与张郑宇为共同通讯作者,武汉大学药学院为该论文第一署名单位。
作为药物研发领域的“明星药效基团”,氮杂环丁烷(Azetidine)具有独特的四元环结构,兼具构象刚性、高应变能与良好稳定性,可有效优化药物分子结构、提升其生物活性,因此该药效基团被广泛应用于抗肿瘤和抗病毒等类别药物设计与研发中。据统计,目前已有数十种含氮杂环丁烷结构的药物或候选药物进入临床阶段,但化学合成方法的局限性一直制约着该结构单元向药物分子的高效转化。非常有趣的是,自然界中也存在多种含氮杂环丁烷药效基团的天然产物,然而迄今科学家们对其生物合成机制仍知之甚少。
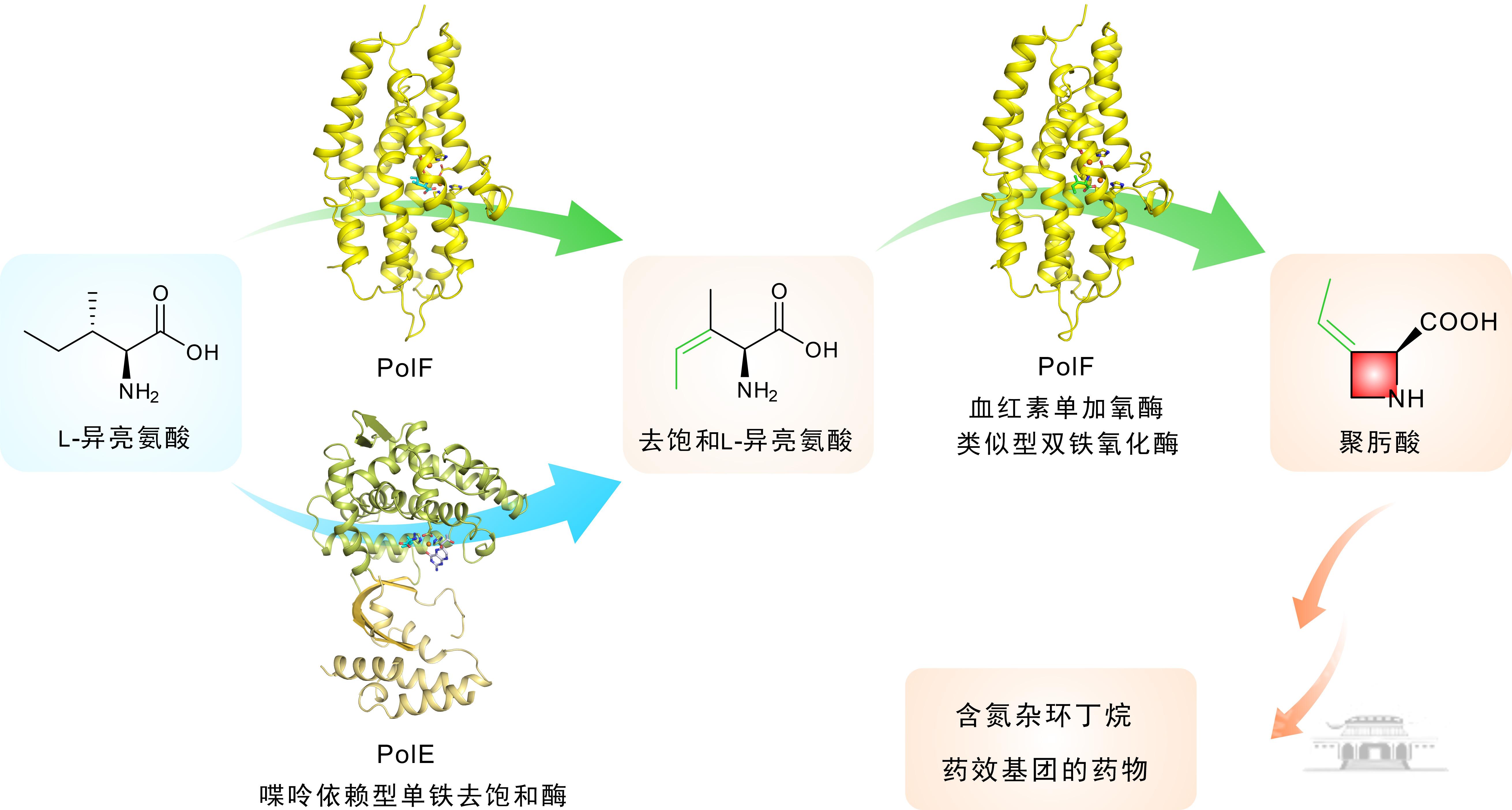

多氧霉素(Polyoxin)为自然界中一类重要的肽核苷类抗生素,由于其具有独特作用机制与卓越抗真菌活性,故迄今为止为开发最成功且未产生耐药性的最佳绿色天然杀真菌剂之一。多氧霉素结构最独特之处在于其含有的氮杂环丁烷药效基团—聚肟酸(Polyoximic acid),然而近半个世纪以来,该药效基团的生物合成机制一直悬而未决,并逐渐成为微生物药物生物合成领域待攻克的科学难题之一。
联合团队历经长期攻关,通过多学科研究手段,完整解析了聚肟酸的生物合成途径,并证明起始底物L-异亮氨酸在两个金属酶PolE和PolF的顺序催化下,进行去饱和与C-N分子内环化,最终形成产物—聚肟酸。令人惊喜的是,研究发现PolF展现出独特的“双功能性”,即其亦可识别L-异亮氨酸形成不饱和中间体,继而催化C-N分子内环化形成聚肟酸。不仅如此,系统研究发现PolE作为首个蝶呤依赖型单铁去饱和酶,能精准活化L-异亮氨酸的C3-H与C4-H,并通过顺序攫氢产生不饱和中间体;而PolF作为新兴的血红素单加氧酶类似型双铁氧化酶(heme-oxygenase-like diiron oxidase,HDO)家族蛋白,可利用其核心螺旋α1-α3构建双铁簇,深入研究揭示其结构中的色氨酸残基W63/W217/W263作为电子供体驱动O-O键均裂,生成高价铁-氧活性物种,进而催化不饱和中间体的高效分子内C-N成环以生成聚肟酸。
据悉,该研究首次揭示了自然界中利用天然氨基酸为底物,通过“脱氢-环化”级联反应高效构建聚肟酸的新颖分子机制,即:PolE作为首例催化去饱和反应的蝶呤依赖型单铁酶,突破了该类酶功能的固有认知,而PolF作为新兴HDO超家族成员,其催化新颖的分子内C-N环化反应,拓展了该类酶催化反应类型的想象空间。可以预计,相关发现为氮杂环丁烷类药效基团的合成生物学创制奠定了坚实的理论依据与实践基础,亦为相关类别药物分子的高效发掘与创新设计提供了崭新的酶学元件与科学支撑,同时对推动我国生物医药及相关产业的融合创新发展具有重要的积极意义。
论文链接:https://www.nature.com/articles/s41557-025-01949-y
供图:药学院 编辑:赵冀帆
来源:武汉大学






































