近日,药学院、泰康生命医学中心教授张帆团队在国际权威期刊《德国应用化学》(Angewandte Chemie International Edition)上发表题为“Discovery of Antivirulence ClpP Inhibitors by Self-Resistance Gene-Guided Mining Coupled with Dual Functional Screening”的研究论文。该研究通过“自抗性基因引导挖掘+双功能验证”策略,实现了ClpP抑制剂的高效精准发现,不仅为抗MRSA治疗提供了具有开发前景的先导化合物,也为靶向天然产物的挖掘提供了可推广的新范式。武汉大学为第一完成单位,药学院博士研究生王勇超为第一作者,张帆为通讯作者。
据世界卫生组织统计,耐甲氧西林金黄色葡萄球菌(MRSA)感染所导致的死亡率已超过乙肝和艾滋病,成为耐药菌感染致死的首要因素。传统抗生素在杀菌过程中容易加速耐药性并破坏人体微生态,而抗毒力药物通过抑制细菌毒力因子,削弱其致病能力,从而减缓耐药性发展。ClpP蛋白酶作为调控金黄色葡萄球菌毒力的关键蛋白,是极具潜力的药物靶标。然而,目前已报道的ClpP抑制剂结构类型有限,且尚无临床候选药物,开发结构新颖、活性优良的ClpP抑制剂成为该领域的迫切需求。
微生物为抵御自身产生的活性代谢产物,常进化出相应的自抗性基因,可作为精准发掘活性化合物的“路标”。本项工作中,团队以ClpP蛋白Cac16为探针,对超过3.4万个放线菌基因组进行挖掘,锁定530个含有潜在ClpP自抗性基因的基因簇,从中优先选择了26个进行实验验证。团队首次建立了一套双功能筛选流程,最终从Streptomycessp. S186菌株中成功发现一类新型ClpP抑制剂streptoclipamides。
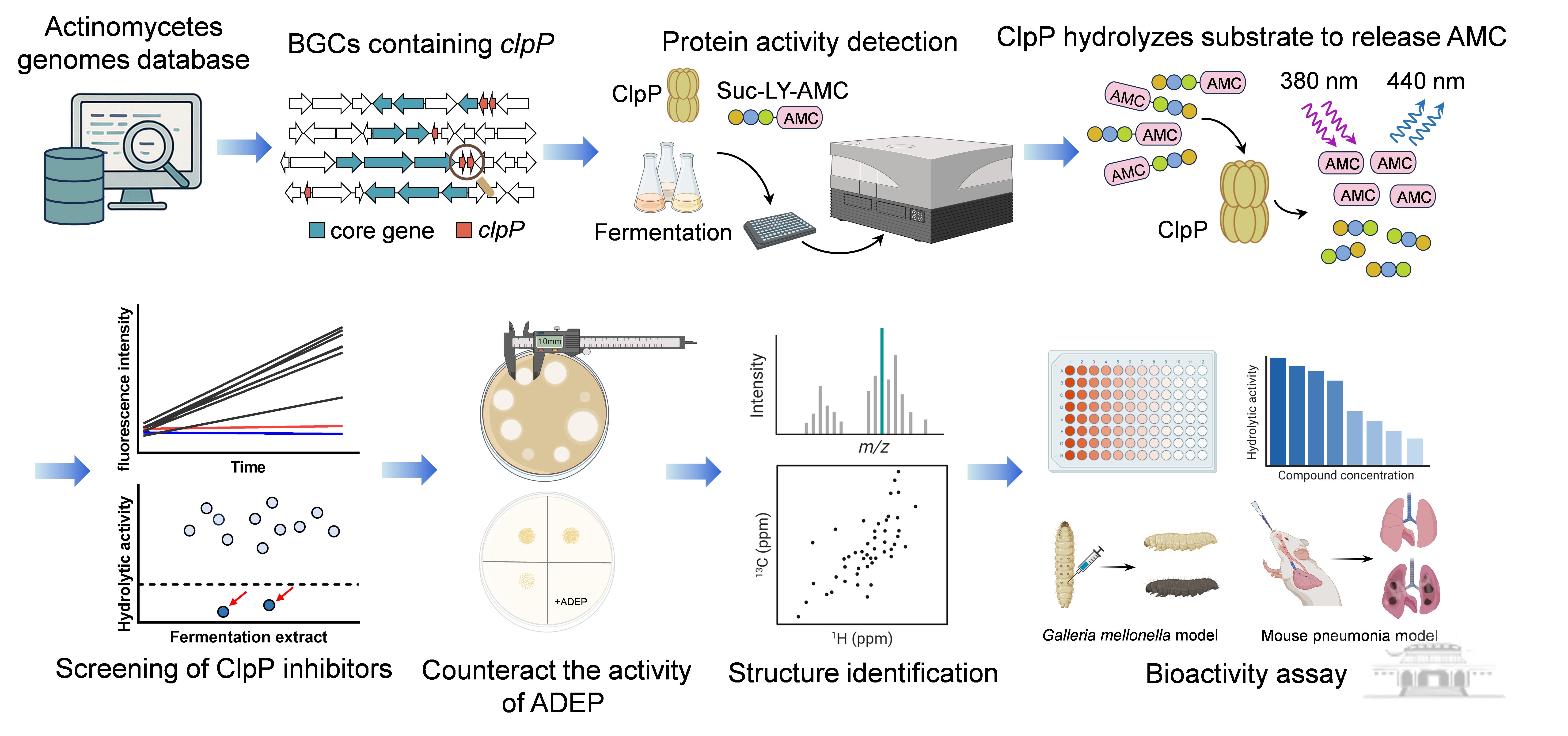

Streptoclipamide A对MRSA来源ClpP蛋白酶的IC₅₀达480 nM,且在高达500 µM浓度下仍不影响细菌生长,表现出典型的抗毒力特征。其可显著抑制关键毒力因子α-溶血素的表达,并下调全局毒力调控基因,从而削弱细菌致病力。机制研究显示,该化合物能够直接结合ClpP蛋白,其关键作用位点为Thr72残基。在MRSA感染的大蜡螟幼虫和小鼠肺炎模型中,该化合物与万古霉素联用展现出显著协同疗效,有效提高宿主存活率、降低肺部菌载并减轻组织损伤。
该研究得到了国家自然科学基金、国家重点研发计划、武汉大学泰康生命医学中心及武汉大学启动经费等项目资助,并得到武汉大学科研公共条件平台的支持。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202514683
供图:药学院 编辑:赵冀帆
来源:南京大学